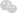一、pH=a酸溶液的稀释常用规律:
(1)强酸溶液稀释时将水看作c(H+)=10-7mol/L的酸,其计算表达式可以表示为:
c(H+)稀释=。于是则有:对于pH=a强酸溶液将体积稀释原来的10n倍时,则所得溶液的pH增大n个单位,即pH=a+n;(注意pH一定小于7)。
(2)对于pH=a弱酸溶液将体积稀释原来的10n倍时,则所得溶液的pH则满足如下不等式关系:a (3)无限稀释,不论酸的强弱,因水的电离已是影响pH的主要因素,pH均趋向于7(当pH接近6的时候,再加水稀释,由水电离提供的
不能再忽略,即强酸的浓度接近于10-7mol/L时,无论稀释多少倍,其pH只能是接近于7,仍要小于7而显酸性。)。
(4)同体积同pH的强酸和弱酸,同倍稀释,强酸的pH变化大化学论文化学论文,弱酸的pH变化小。
例1、稀释下列溶液时,pH值怎样变化?
(1)10mLpH=4的盐酸,稀释10倍到100mL时,pH=
(2)pH=6的稀盐酸稀释至1000倍,pH=
解析:(1)pH=4,即[H+]=1×10-4mol/L,稀释10倍,即c(H+)=1×10-5mol/L,
所以pH=5。
(2)当强酸、强碱溶液的H+离子浓度接近水电离出的H+离子浓度(1×10-7mol/L)时,水电离出的H+离子浓度就不能忽略不计中国论文下载中心论文的格式。所以pH=6的稀盐酸,稀释1000倍时:c(H+)=(1×10-6+999×10-7)/1000=1.009×10-7 mol/L, pH=6.99,由此可知溶液接近中性而不会是pH=9。
例2、 常温下pH=1的两种一元酸溶液A和B,分别加水1000倍稀释,其pH与所加水的体积变化如下图所示,则下列结论中正确的是( )
(A)A酸比B酸的电离程度小 (B)B酸比A酸容易电离
(C)B是弱酸,A是强酸 (D)pH=1时,B酸的物质的量浓度比A酸大
解析:如果一元酸是强酸,pH=1时,c(H+)=1×10-1mol/L,加水稀释103倍后,此时,c(H+)=1×10-4mol/L,pH=4。如果是一元弱酸,则1
二、pH=a碱溶液的稀释常用规律:
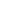
(1)强碱溶液稀释时将水看作c(H+)=10-7mol/L的碱,其计算表达式可以表示为:
c(OH-)稀释=。于是则有:对于pH=a强碱溶液将体积稀释到原来的10n倍时,则溶液的pH减小n个单位(最后结果不得小于或等于7)。
(2)对于pH=a弱碱,溶液将体积稀释到原来的10n倍时,a-n (3)无限稀释,不论碱的强弱,因水的电离已是影响pH的主要因素,pH均趋向于7(当pH接近8的时候,再加水稀释,由水电离提供的
不能再忽略,即强碱溶液中的[OH-]≤10-8mol/L时化学论文化学论文,则无论稀释多少倍,其pH只能接近于7,仍大于7而显碱性)。
(4)同体积同pH的强碱和弱碱,同倍稀释,强碱的pH变化大,弱碱的pH变化小。
例3、稀释下列溶液时,pH值怎样变化?
(1)pH=11的NaOH溶液稀释100倍,所得溶液的pH=
(2)pH=11的NH3·H2O溶液稀释100倍,所得溶液的pH=
(3)pH=9的NaOH溶液稀释1000倍,所得溶液的pH= 解析:(1)pH=11的NaOH溶液稀释100倍,稀释后所得溶液中c(OH-)仍以NaOH
溶液中c(OH-)占主导,所以可直接利于规律(1)求得所得溶液的pH为9。
(2)因为NH3·H2O溶液为弱电解质,存在电离平衡,可直接利于规律(2)求得所得溶液的pH为:9
(3)pH=9的NaOH溶液稀释1000倍时,由水电离提供的OH- 不能忽略,其pH只能接近于7
例4、把1mL0.2mol/L的NaOH加水稀释成2L溶液,在此溶液中由水电离产生的
OH-,其浓度接近于
(A) 1×10-4 mol/L (B) 1×10-8 mol/L
(C) 1×10-11 mol/L (D) 1×10-10mol/L
解析:温度不变时,水溶液中氢离子的浓度和氢氧根离子的浓度乘积是一个常数。在酸溶液中氢氧根离子完全由水电离产生,而氢离子则由酸和水共同电离产生。当碱的浓度不是极小的情况下,由碱电离产生的氢氧离子总是远大于由水电离产生的(常常忽略水电离的部分),而水电离产生的氢离子和氢氧根离子始终一样多。所以,碱溶液中的水电离的氢离子的求算通常采用求算氢氧根离子。
稀释后C(OH-) =(1×10-3L×0.2mol/L)/2L = 1×10-4mol/L,
C(H+) = 1×10-14/1×10-4 = 1×10-10 mol/L,所以答案可选(D)。
三、同体积同pH的一强和一弱,稀释到同pH时,体积大小关系
(1)体积相同,pH相同的强酸溶液与弱酸溶液,分别加水稀释m倍和n倍,稀释后溶液的pH仍相同,则m与n的关系为m
(2)体积相同,物质的量浓度相等浓度的强酸溶液与弱酸溶液,分别加水稀释m倍和n倍,稀释后溶液的pH仍相同,则m与n的关系为m>n,即强酸溶液稀释的倍数大。
同理:强碱溶液与弱碱溶液化学论文化学论文,上述(1)(2)结论仍成立中国论文下载中心论文的格式。
例5、体积相同,浓度为0.1mol/L的NaOH溶液、氨水,分别加水稀释m倍和n倍,溶液的pH都变为9,则m与n的关系为( )
(A)4m=n (B)m=n(C)mn
解析:若稀释相同倍数,则稀释后NaOH溶液和氨水的物质的量浓度相等,但是NaOH溶液的pH大,要使pH相同,则NaOH溶液稀释的倍数大些,所以m>n选(D)。
例6、体积相同,pH相同的NaOH溶液、氨水,分别加水稀释m倍和n倍,稀释后溶液的pH仍相同,则m与n的关系为( )
(A)4m=n(B)m=n (C)mn
解析:体积相同,pH相同的NaOH溶液、氨水若稀释相同倍数,则稀释后NaOH
溶液的pH变化大(即减小程度大),而氨水的pH变化小(即减小程度小),因为稀释过程中氨水的电离程度增大,要使pH相同,则氨水溶液稀释的倍数大些,所以m